中国临床重症研究已终止 瑞德西韦“神药”破灭?(组图)

时隔两个多月,被称为最有希望成为治疗新型冠状病毒肺炎“神药”的瑞德西韦,终于有了首个临床研究结果。
据吉利德在《新英格兰医学杂志》发布的研究内容,在同情用药情况下使用瑞德西韦的53名患者中均为新冠病毒肺炎严重并发症的住院患者。总体看,瑞德西韦给68%的患者带来了临床改善。此外,该队列的总死亡率为13%。在安全性上,总计有32名患者出现副作用,有12名患者出现严重副作用。
4月11日下午,上海市新冠肺炎医疗救治专家组组长张文宏在人民日报直播间表示,瑞德西韦可以算是有效药物,但不是特效药。
此外,吉利德科学官网上4月11日发布了一封公司董事长兼首席执行官Daniel O’Day的公开信,其表示,在中国的瑞德西韦研究,因入组停滞,针对重症患者的研究已终止。
值得一提的是,在A股市场上,曾有博瑞医药、物产中大等多家上市公司搭车炒作瑞德西韦,股票大涨后遭到监管。
同情用药68%的患者临床有改善
中国临床重症研究已终止
根据吉利德发布的研究成果,该队列评估了来自美国、欧洲、加拿大和日本的53名患者的数据,这些患者通过吉利德的同情用药项目,在2020年3月7日或之前接受了至少一剂瑞德西韦的治疗。
数据显示,首次使用瑞德西韦后18天的中位随访期内,68%接受瑞德西韦治疗的患者的氧气支持水平得到改善。随访28天后,根据Kaplan-Meier分析,临床改善的累积发生率为84%。
此外,该队列的总死亡率为13%,有创通气患者亚组的死亡率18%,相较于无创通气支持患者的死亡率5%更高。在安全性上,总计有32名患者出现副作用,最常见的是肝脏酶指标升高、腹泻、皮疹、肾功能障碍和高血压。总计有12名患者出现严重副作用。
吉利德表示,同情用药数据存在局限性,因为用药队列的规模小,随访时间相对较短,同情用药的性质本身可能导致数据丢失,且缺乏随机对照组,“我们仍需要正在进行中的瑞德西韦随机的临床研究数据,才能对瑞德西韦治疗的临床影响提供科学可靠的认识。”
值得注意的是,目前在中国进行的针对重症患者研究已经提前终止。
吉利德称,由于入组人数低,在中国进行的针对重症患者的研究已提前终止。公司正在等待这些数据的发布,以便对结果进行深入评估。在中国,对轻至中度患者的研究还在进行中。
根据此前吉利德披露的信息,在中国的临床试验预计四月份获得结果。
全球已有1800人接受瑞德西韦治疗
吉利德此前放弃孤儿药资格
瑞德西韦,一种在研核苷酸类似物,在体外和动物模型中,瑞德西韦对包括埃博拉、马尔堡、中东呼吸综合征和非典型性肺炎在内的多种新兴病毒病原体均有广谱抗病毒活性。根据吉利德此前公布信息,体外测试表明瑞德西韦对新型冠状病毒具有活性。
在新型冠状病毒疫情发生以来,瑞德西韦在2月初广泛进入公众视野。当时吉利德宣布,正与全球的卫生机构密切合作,提供在研药物瑞德西韦用于试验性治疗,以支持应对新型冠状病毒感染的暴发。
根据吉利德披露的临床试验信息,2月初,中国启动了最早的两项对重症和中症患者的研究。此后新增的五项瑞德西韦试验在世界各地启动。
4月11日吉利德披露,以个例为基础,1800多名患者已经通过同情用药方式,接受了瑞德西韦的治疗。此外,目前瑞德西韦的多个二期和三期临床研究正在进行中,以评估瑞德西韦治疗新型冠状病毒肺炎的安全性和有效性,预计4月底可以获得初步的临床研究数据。
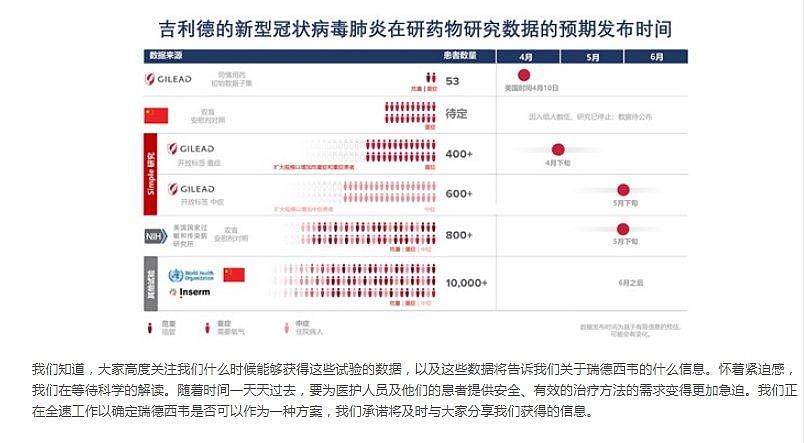
4月11日,吉利德公布的新型冠状病毒肺炎在研药物研究数据逾期发布时间 来源:吉利德官网
值得注意的是,作为尚未在任何国家上市的在研药物,瑞德西韦在今年3月取得了美国食品药品管理局(FDA)授予的孤儿药资格。
3月27日,瑞德西韦宣布,已经向美国食品药品管理局(FDA)提交申请,要求取消其授予新型冠状病毒肺炎的在研抗病毒药物瑞德西韦的孤儿药资格,同时放弃与该资格认定相关的所有权益。
吉利德称,有信心在没有孤儿药资格的情况下,也可以继续对瑞德西韦监管审评的快速推进。
多家A股上市公司因蹭瑞德西韦热点遭罚
2月初,随着吉利德在全球宣布瑞德西韦的临床研究动态,国内的部分吉利德的合作方也纷纷做出与吉利德或瑞德西韦相关的表态,而其中,也有上市公司因蹭热点瑞德西韦遭批评。
2月4日上市公司博腾股份公告,吉利德为公司核心客户。博腾股份称,公司于2015年开始为吉利德科学在研抗病毒药物瑞德西韦提供定制研发生产服务,并于2016年多次交付临床需求的高级中间体,“截至目前,根据公司掌握的业务信息,上述事项不会对公司2020年度业绩产生重大影响”
另一边,上市公司九洲药业也提示投资者,与吉利德未就新型冠状病毒肺炎在研药物瑞德西韦开展实质性合作。美迪西也表示,公司与吉利德2009年开始合作,对吉利德2019年度的销售收入为322.89万元,未直接参与吉利德瑞德西韦等抗肺炎药物的研发。
2月4日,永太科技在投资者问答平台表示,公司下游客户包括吉利德、拜尔等企业。近期公司得知吉利德公司在研药物瑞德西韦可用于治疗新型冠状病毒肺炎,公司正积极与吉利德公司等下游客户接洽,寻求可能的合作机会。
但在2月20日,永泰科技就因为在投资者问答平台发布该消息的时间问题,收到了中小板公司管理部的监管函。
2月11日,上市公司博瑞医药宣布,公司成功开发了瑞德西韦原料药合成工艺技术和制剂技术,并已经批量生产出瑞德西韦原料药,瑞德西韦制剂批量化生产正在进行中。次日,博瑞医药时任董秘在接受媒体采访中表示,公司的瑞德西韦生产“不是实验室的那种样品,而是可以批量生产”。
该消息发布后,让博瑞医药股票迅速上涨。而上交所3月1日的监管措施决定显示,博瑞医药公告所称“批量生产”实际为药 品研发中小试、中试等批次的试验性生产。最终博瑞医药遭通报批评,还收到了江苏证监局的警示函。
在2月13日,上市公司物产中大在“上证 e 互动”宣布旗下子公司的 “抗新型冠状病毒肺炎特效药瑞德西韦10T/制剂1000万支”项目获得江苏省启东市北新镇人民政府备案通过。当日晚间,物产中大经监管层督促提交风险提示公告,补充提示瑞德西韦项目的不确定风险及科本药业本身对公司经营业绩无重大影响。
上交所认为,物产中大补充发布的风险提示过于概括,“也未作出有针对性 的风险提示,相关信息披露不完整。”物产中大上述行为违反了有关规定,对物产中大及公司董秘采取通报批评的监管措施。
专题:武汉爆发新冠肺炎进入专题 >>
英国前首相:新冠病毒源头极有可能来自中国实验室(图)
新冠阳性率上升?武汉疾控提醒:不必恐慌(图)
全身溃烂生不如死,丧失生育功能,武汉首批新冠患者结局如何(组图)













 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


