石破天惊!中企成功仿制批量生产出美国神药原料药(组图)
博瑞医药晚间发布关于抗病毒药物研制取得进展的公告。
公告称,博瑞生物医药(苏州)股份有限公司(以下简称“公司”)积极响应国家抗击新型冠状病毒(2019-nCoV)疫情的号召,于近日成功仿制开发了瑞德西韦原料药合成工艺技术和制剂技术。公司已经批量生产出瑞德西韦原料药,瑞德西韦制剂批量化生产正在进行中。
公司将持续关注瑞德西韦的III期临床试验结果,并根据国家和社会需要,及时开展后续工作。
石破天惊!博瑞医药已批量生产瑞德西韦原料药
2月11日晚,博瑞医药(688166.SH)发布公告称,公司近日完成了对瑞德西韦仿制技术的研发,并批量生产了瑞德西韦。
公告显示,瑞德西韦由美国 Gilead 公司开发,用于防治埃博拉病毒感染,Gilead 公司是瑞德西韦的化合物专利权人。瑞德西韦已经在国外通过了Ⅰ期和Ⅱ期临床试验,目前 Gilead 公司正在与国内机构配合,对瑞德西韦用于新型冠状病毒(2019-nCoV)感染进行Ⅲ期临床试验。
博瑞医药公告称,公司已经“成功开发了瑞德西韦原料药合成工艺技术和制剂技术,并已经批量生产出瑞德西韦原料药,瑞德西韦制剂批量化生产正在进行中。 ”
值得注意的是,博瑞医药完成瑞德西韦原料药的仿制和制剂生产后,需经过药物临床试验、药品审批等多个环节。若瑞德西韦最终转化为产品投入市场,需要获得 Gilead 公司作为专利权人的授权;这一过程将存在重大不确定性。
截至目前,博瑞医药在瑞德西韦的原料药和制剂开发和生产中已发生的成本预计约为 500 万元,后续进一步放大生产,预计还需要投入约 1000 万元。
若该产品能够获批上市,疫情期间主要通过捐赠等方式供应给相关病人,博瑞医药表示“预计不会对公司 2020 年度经营业绩产生重大影响。 ”
网站售卖“瑞德西韦”?专家:不是药,人不能用
前几日,一个名为“美国GLPBIO中文站”(https://glpbio.cn/)的网站,出售多种规格的“瑞德西韦”,其中5毫克卖4950元,10毫克卖7650元。《中国科学报》记者与“美国GLPBIO中文站”客服联系核实,他表示,之前网站确实售卖了“瑞德西韦”,但并非成药,而是用于科研用途的试剂,最近因为科研机构把库存订完了,所以就下架了。
不过,记者查询发现,除“美国GLPBIO中文站”外,“Chemical Book” 网站上(https://www.chemicalbook.com)也正在出售由江苏一家公司提供的“瑞德西韦”。
对此,《中国科学报》记者联系了相关专家。专家表示,网上正在售卖的“瑞德西韦”只是用于科研的化合物,并非药物,不能给人用。即使瑞德西韦三期临床试验取得成功,瑞德西韦到审批上市(即能在医院或药店购买到)也还需时日。
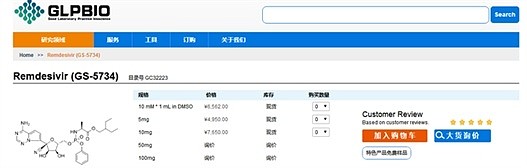
“美国GLPBIO中文站”此前的销售页面
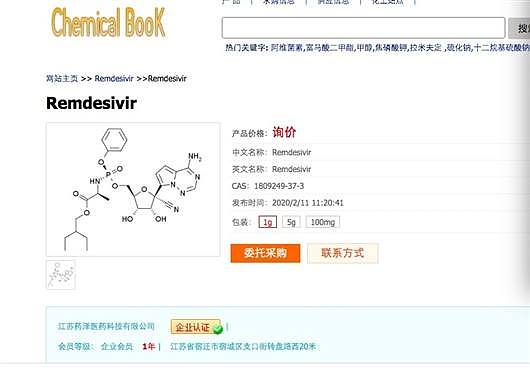
其他在售网站
《中国科学报》:为什么瑞德西韦的化合物会卖这么贵?这是否意味着以后生产出来的药物也会更贵?
张志文(中国科学院药物研究所研究员):
10毫克7000多块钱,价格非常昂贵,因为
(1)前期的研究与发现中消耗了大量的人力、物力和时间等资源,经过大量的失败后才成功筛选出该化合物,成本非常高;
(2)瑞德西韦化合物需求量小,使用频率低,没有规模化效应。
药物研究专家:
这个化合物就是供做科研用的,需求量很少,也不会进行大规模商业化生产。合成的量少,成本就会比较高,卖得就会贵一些。如果需求量增大,成本就会大规模下降。
《中国科学报》:商家称商品“卖给科研机构”,科研机构的样品都是从哪里买的?
张志文:
科研机构的样品一般分为基础科研用样品和药物研发用样品,对于科研用样品一般可以自己合成、委托公司代为合成或直接从试剂公司购买;对于药物研发用样品,必须从“原料药、药用辅料和药包材登记平台与数据库”中选取有登记号的产品,或按照要求自行申请登记。
药物研究专家:
科研机构的实验样品大部分是从试剂公司买到的,渠道不少。至于试剂的价格,试剂公司会依据科研机构“需求量多少”和“多久之内要”来定。
《中国科学报》:化合物与药有什么区别?从化合物到药物,需要经过哪些流程?
张志文:
从化合物到药物上市的研发是一个漫长、复杂、高投入而失败率又极高的过程,国外成功上市一个创新药物平均需要10-15年,资金投入平均约10-15亿美元。从化合物到药物的研发主要经过以下5个流程:
一是先导化合物的发现,从大量化合物中寻找和筛选出最有可能治疗疾病的活性化合物,进行后续的研究开发。
二是候选药物的临床前研发,从先导化合物中优选出来的活性化合物一般被称为候选新药,需要根据国家新药申报的相关要求,选用合适的辅料等制备成临床上能够使用的制剂如片剂、胶囊等,需要进行药学、药理与药效、药物动力学、药物代谢和药物安全性等全方面的评价。
三是申请临床试验许可,在按照国家新药申报各项要求完成各项研究后,研发机构将全部申报资料提交国家新药评审中心,申请临床批件或临床试验许可。
四是临床试验。I期临床是健康志愿者开展药物动力学和安全性评价,监测试验药物的血液浓度、排泄性质和任何有益反应或不良作用,为制定给药方案提供依据。II期临床是治疗作用的初步评价,对少数患者进行药代动力学、排泄情况以及初步疗效评价,对试验药物的有效性和安全性进行初步评价。III期临床是临床疗效的确证阶段,是在大样本患者中开展的扩大的多中心随机化盲对照试验,将试验药物与治疗同类疾病的上市药品或安慰剂(不含活性物质)进行比较,验证试验药物的优效性和安全性,为药品注册申请获得批准提供关键依据。
五是药品上市与四期临床。III期临床试验成功后即可申请药物上市,同时进行生产工艺的规模化和标准化验证,申请生产批件和新药证书,审批上市后才能成为医院和药房中提供的患者能够使用的药品。新药上市后还需要进行IV期临床试验,考察新药在广泛使用条件下的疗效和不良反应等。
药物研究专家:
商家售卖的是瑞德西韦的化合物,是供基础研究用的,和给人临床用的不一样。化合物只能保证结构正确,不能保证质量,因此不能给人用。
药物是在符合GMP(良好作业规范)条件下的车间生产的,每一批都有一定的规模,且符合国家标准,制备成冻干粉针后,用粉针给人注射。药品质量要做到可控、可重复性好、安全,如果有杂质的话,很可能对人体有害,但是科研用的化合物不用考虑这些问题。
专题:武汉爆发新冠肺炎进入专题 >>
李文亮医生五周年忌,海内外网友悼念,吁言论自由(组图)
白宫:新冠病毒源自中国实验室是“可证实的事实”(图)
李文亮逝世五周年!父母痛诉:未能见最后一面(视频/组图)












 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


